Epidemiological and histological profile of central nervous system tumors in Dakar
Profil épidémiologique et histologique des tumeurs du système nerveux central à Dakar
FAC. Cheumaga1, K. Ka1, MB. Ba1, M. Mane1, AC. Diallo2, PM. Diéne1, AS. Badiane3, I. Thiam3, FN. Sarr3, H. Rachidou1, PM. Gaye1.
1 Centre Hospitalier National Dalal Jamm, Sénégal.
2 Centre Hospitalier Régional de Saint-Louis, Sénégal.
3 Hôpital Aristide Le Dantec, Sénégal.
DOI: 10.54266/ajo.2.1.19.v8Izbix3zh
ABSTRACT
INTRODUCTION: Tumors of the central nervous system are rare. They are responsible for significant mortality and morbidity. Histological types vary with age. The objective of this study was to determine the epidemiological and histological profile of central nervous system tumors at Dalal Jamm National Hospital. MATERIALS AND METHODS: We conducted a retrospective descriptive study of patients managed in the oncology-radiotherapy department of Dalal Jamm National Hospital Center from November 2018 to October 2021. Age, gender, main presenting signs, tumor of origin for secondary lesions, topography of tumors, and histological types were studied. RESULTS: We collected 82 cases of central nervous system tumors. The median age of the patients was 43 years with extremes of eight and 73 years. Seventy-three-point two percent of the cases found were female. Children represented 8.5% of the study population. The most frequent clinical signs at diagnosis were headache (68.3%), decreased visual acuity (28%) and nausea/vomiting (24.4%). The majority of the cases were secondary tumors of breast (58.6%) and lung (5.2%) origin. Primary tumors were dominated by glioblastoma (39.1%). CONCLUSION: Tumors of the central nervous system are rare in Senegal and generally observed in adults. They are mostly secondary to breast cancer and glioblastoma is the most frequent primary tumor.
KEYWORDS: Epidemiology; Tumor; Central nervous system, Senegal.
RESUME
INTRODUCTION : Les tumeurs du système nerveux central sont rares. Elles sont responsables d’une mortalité et d’une morbidité importantes. Les types histologiques varient selon l’âge. L’objectif de cette étude était de déterminer le profil épidémiologique et histologique des tumeurs du système nerveux central au Centre Hospitalier National Dalal Jamm. MATERIELS ET METHODES : Nous avons mené une étude rétrospective descriptive concernant les patients pris en charge dans le service d’Oncologie-Radiothérapie du Centre Hospitalier National Dalal Jamm de Novembre 2018 à Octobre 2021. L’âge, le sexe, les principaux signes révélateurs, la tumeur d’origine pour les lésions secondaires, la topographie des tumeurs, et les types histologiques ont été étudiés. RESULTATS : Nous avons colligé 82 cas de tumeurs du système nerveux central. L’âge médian des patients était de 43 ans avec des extrêmes de huit et 73 ans. Soixante-treize virgule deux pour cent des cas trouvés étaient des femmes. Les enfants représentaient 8,5% de la population étudiée. Les signes cliniques les plus fréquents au diagnostic étaient les céphalées (68,3%,), la baisse de l’acuité visuelle (28%) et les nausées/vomissements (24,4%). Il s’agissait de 72% de tumeurs secondaires dont la majorité était d’origine mammaire (58,6%) et pulmonaire (5,2%). Les tumeurs primitives étaient dominées par le glioblastome (39,1%). CONCLUSION : Les tumeurs du système nerveux central sont rares au Sénégal et généralement observées chez l’adulte. Elles sont majoritairement secondaires d’un cancer du sein et le glioblastome est la tumeur primitive la plus fréquente.
MOTS-CLES : Epidémiologie ; Tumeur ; Système nerveux central ; Sénégal.
INTRODUCTION
Dans le monde, 308.102 nouveaux cas de tumeurs du système nerveux central (SNC) ont été recensés en 2020 soit 1,6% de tous les cancers (1). Elles ont représenté 1,5% des tous les nouveaux cas de cancer diagnostiqués en Afrique de l’Ouest et 2,1% des décès par cancer au Sénégal (2). Ces tumeurs constituent une cause importante de morbidité et de mortalité surtout chez les enfants et les jeunes adultes (3). Les circonstances de découverte sont diverses mais nous retrouvons fréquemment l’hypertension intracrânienne (18,8%), le syndrome cérébelleux (13,67%) et le déficit moteur (11,96%) (4). Chez l’adulte, la pathologie tumorale primitive maligne est dominée par le glioblastome (48,6%) et la pathologie tumorale bénigne par le méningiome (53,9%) (5). Chez l’enfant, les tumeurs les plus fréquentes sont l’astrocytome pilocytique (17,5%) et les tumeurs embryonnaires (15,7%) avant 14 ans et les tumeurs pituitaires (24,7%) entre 15 et 19 ans (6). L’objectif de notre étude était de déterminer le profil épidémiologique, clinique et histologique des tumeurs du système nerveux central au Centre Hospitalier National Dalal Jamm de Dakar.
MATERIELS ET METHODES
Caractéristiques des patients
Nous avons mené une étude rétrospective descriptive dans le service d’Oncologie-Radiothérapie de l’Hôpital Dalal Jamm. Nous avons inclus les dossiers de tous les patients traités pour des tumeurs du SNC entre Novembre 2018 et Octobre 2021 ayant bénéficié d’une confirmation histologique ou fortement suspectes au regard du bilan radiologique et du contexte clinique.
Données étudiées
Après identification des patients à partir du système informatique d’enregistrement, les données ont été recueillies à partir des dossiers médicaux. Une fiche de recueil de données conçue pour l’étude a été utilisée. Pour chaque patient les données suivantes ont été recueillies : caractéristiques socio-démographiques (âge selon le Central Brain Tumor Registry of the United States (CBTRUS) et sexe), histoire clinique (statut de performance de l’Organisation Mondiale de la Santé, les signes cliniques neurologiques et extra-neurologiques et le délai entre le diagnostic de la tumeur primitive et celui des métastases, caractéristiques radiologiques (topographie et le nombre de lésions), données histologiques (type histologique des tumeurs cérébrales et celui des lésions primitives extra-cérébrales) et le déroulement de la radiothérapie (délai entre l’exérèse chirurgicale et le début de la radiothérapie pour les tumeurs opérées, la dose totale et le fractionnement).
Analyse statistique
Les données statistiques ont été analysées à l’aide du logiciel SPSS 23. Les variables catégorielles ont été présentées sous forme de fréquence (n) et de pourcentage (%).
RESULTATS Les données démographiques sont présentées dans le tableau I. Nous avons colligé 82 cas de tumeurs du SNC sur une durée de trois ans soit 5,78% de tous les cancers traités par radiothérapie dans ce service pendant la période d’étude. L’âge des patients variait de huit ans à 73 ans pour un âge médian de 43 ans. Le sexe-ratio était de 0,36. Dans notre étude, la population pédiatrique (enfants ayant un âge inférieur ou égal à 19 ans) représentait 9,8% tandis que celle des adultes était de 90,2%. Le statut de performance de l’Organisation Mondiale de la Santé était de 1 chez 48,8% des patients.
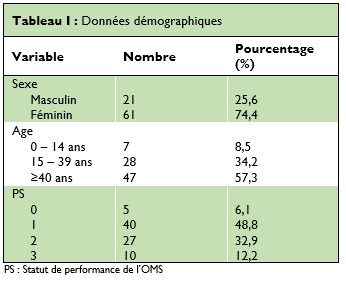
Au moment du diagnostic la symptomatologie était dominée par les signes d’hypertension intracrânienne (les céphalées, la baisse de l’acuité visuelle et les nausée/vomissements respectivement chez 68,3%, 28%, et 24,4% des patients) et les vertiges et le déficit moteur dans respectivement chez 22% et 20,7% des cas (Figure 1).
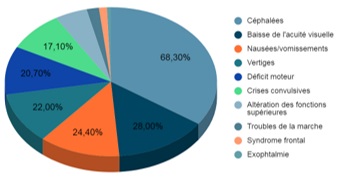
Une tomodensitométrie (TDM) a été réalisée chez 75 patients (91,5%) et le reste des patients soit sept patients (8,5%) a bénéficié d’une imagerie par résonance magnétique (IRM). Tous âges et tous types histologiques confondus, la localisation de la tumeur a été précisée chez 30 patients. Ceux-ci présentaient des lésions multiples dans 53,3% des cas. Il s’agissait pour la majorité de lésions secondaires. Soixante-trois virgule trois pour cent des patients présentaient des lésions sus-tentorielles et 26,7% des lésions multiples sus-tentorielles et sous-tentorielles (Tableau II).
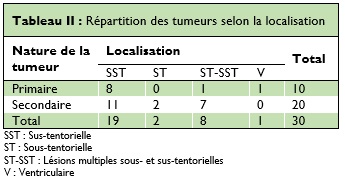
Concernant le type histologique, nous avons trouvé 28% de tumeurs primitives. Il s’agissait de glioblastome dans 39,1% des cas, de méningiome dans 17,3% des cas et de craniopharyngiome dans 13% des cas (Figure 2).
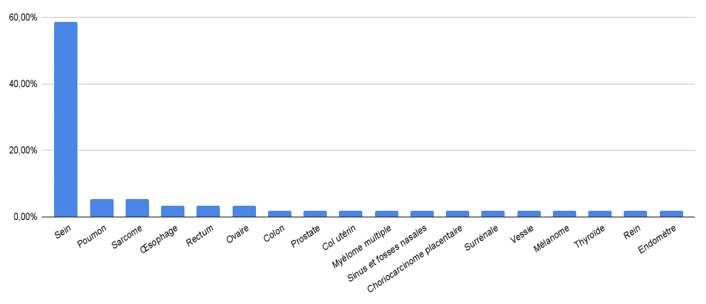
Les tumeurs secondaires représentaient 72% des cas trouvés. Leur origine était le cancer du sein (58,6%) suivi du cancer du poumon et des sarcomes (5,2%), puis du cancer de l’œsophage, du cancer du rectum et du cancer de l’ovaire (3,4%). Les autres cancers primitifs représentaient 1,7% des cas chacun (Figure 3).
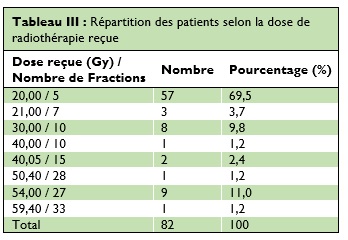
Le délai entre l’exérèse chirurgicale et le début de radiothérapie variait de quatre à 60 semaines avec une moyenne de 21 semaines. Le diagnostic de lésions secondaires cérébrales a été posé un mois à 11 ans après celui de la tumeur primitive. Celles-ci ont été mises en évidence par l’imagerie au décours d’une suspicion clinique. La dose délivrée en cas de tumeur secondaire était de 20 Gy à 40 Gy en fractions de trois à quatre Gy, cinq jours par semaine. Il s’agissait d’une irradiation de l’encéphale en totalité avec chez certains patients une surimpression de dose au sein de la tumeur. Les patients avec des tumeurs primitives ont reçu 30 Gy à 60 Gy en fractions de deux à trois Gy, cinq jours par semaine (Tableau 3).
DISCUSSION
Incidence et caractéristiques démographiques
Les tumeurs du SNC sont peu fréquentes. Durant la période d’étude, 82 cas ont été colligés soit une incidence de 27 cas par an. Sur une période de neuf ans, Motah et al (7) en ont trouvé 150 dans un hôpital de référence de Douala soit une incidence de 15 cas par an. Cette incidence est probablement sous-estimée car de nombreux patients ayant besoin de traitement adjuvant ne sont pas systématiquement adressés en radiothérapie et de ceux qui le sont, certains sont référés vers les autres centres de radiothérapie de la ville de Dakar. Environ trois-quarts de nos patients étaient de sexe féminin. Ce résultat est proche de celui trouvé par Tongavelona et al (4) à Antananarivo à Madagascar. A l’hôpital de Memfys à Enugu au Nigéria, Ndubuisi et al (8) ont, quant à eux, retrouvé 54,4% d’hommes. L’âge médian de nos patients était de 43 ans ce qui est proche de celui de 39,8 ans, retrouvé par Andrew et al (9) au Ghana. La littérature retrouve une nette prédominance des tumeurs du SNC chez les patients d’au moins 40 ans (5,10–13). Ces résultats sont similaires à ceux trouvés dans notre série.
Présentation clinique
La présentation clinique au diagnostic était dominée par les signes d’hypertension intracrânienne (céphalées, baisse de l’acuité visuelle et nausées/vomissements). Celle-ci est en rapport avec l’œdème cérébral péri-tumoral et la rigidité de la boîte crânienne (14,15). Les céphalées sont retrouvées chez 48 à 71% des patients porteurs de tumeurs cérébrales ce qui correspond à nos résultats (16). Les crises convulsives, quant à elles, ont été trouvées chez 17,1% de nos patients en deçà des proportions de 40 à 60% rapportés par Vecht et al (17). La pathogenèse des crises convulsives d’origine tumorale est multifactorielle. Elles sont moins fréquentes en cas de gliome de haut grade et de tumeurs secondaires (18). Ceci pourrait expliquer le taux retrouvé dans notre série dans laquelle les tumeurs secondaires étaient les plus fréquentes et le glioblastome la tumeur primitive la plus retrouvée. L’imagerie par résonance magnétique (IRM) est la technique d’imagerie recommandée pour l’exploration des tumeurs cérébrales. Ceci est dû à sa résolution, à son profil de sécurité élevé pour les patients et à sa plus grande sensibilité par rapport à la tomodensitométrie (19–21). Les difficultés d’accès à l’IRM au Sénégal font de la TDM la technique d’imagerie la plus utilisée dans le diagnostic et le suivi des patients avec des tumeurs cérébrales. La neuro-navigation est une technique de plus en plus utilisée pour simuler une approche chirurgicale avant la chirurgie. Elle a un rôle essentiel dans la réalisation de biopsies en cas de tumeur du SNC non résécable (22,23). Son inaccessibilité au Sénégal amène souvent à poser des indications de radiothérapie sans preuve histologique.
Types histologiques
Les tumeurs secondaires étaient les plus fréquentes dans notre série. Ce résultat est différent de celui rapporté par Thiam et al (24) dans leur étude menée à l’Hôpital Universitaire de Fann à Dakar entre 2010 et 2017. Ils avaient trouvé une fréquence de 2,9%. Cette minorité de tumeurs secondaires était également rapportée dans d’autres séries (25–27). Nous pensons que l’incidence de tumeurs primitives rapportée dans notre série est sous-estimée à cause de différentes raisons : notre série est limitée aux données d’un service d’oncologie, les patients atteints de tumeurs cérébrales bénignes complètement réséquées ou ayant un faible profil évolutif ne sont pas systématiquement adressés en radiothérapie, le décès des patients survenant après l’exérèse chirurgicale et avant que le compte-rendu anatomopathologique des pièces opératoires ne soit disponible, l’absence d’assurance maladie et le faible statut socio-économique qui rendent le traitement de radiothérapie inaccessible pour de nombreux patients. Dans d’autres régions du monde, les tumeurs du SNC sont dominées par les lésions métastatiques (28–30). Ceci pourrait être en rapport avec une plus grande disponibilité de moyens thérapeutiques efficaces et donc d’une meilleure survie mais aussi avec l’amélioration des techniques d’imagerie portant sur le SNC. Dans notre cohorte, les tumeurs secondaires étaient d’origine mammaire dans la plupart des cas suivi du cancer du poumon. La faible prévalence du tabagisme en Afrique, comparée aux pays occidentaux pourrait expliquer ce résultat. En effet, le tabac est le facteur de risque le plus incriminé dans le cancer du poumon. Le cancer du sein est de ce fait bien plus fréquent en Afrique que celui du poumon qui est souvent découvert tardivement et essaime également dans le cerveau (1,31–34). Les gliomes sont les tumeurs primitives les plus fréquentes de l’adulte. Il s’agit d’astrocytomes dans la majorité des cas (35). Le sous-type histologique étant dominé par le glioblastome (36–38). Ces résultats sont similaires à ceux rapportés dans notre série. Cette étude, malgré son caractère rétrospectif, révèle un défaut de coordination entre les différents services de prise en charge des patients avec des tumeurs cérébrales, une absence de centralisation des données de ceux-ci ainsi que l’inaccessibilité des patients à des moyens diagnostiques de qualité responsables d’un retard dans la prise en charge.
CONCLUSION
Les tumeurs du système nerveux central sont peu fréquentes dans notre contexte. Elles sont plus fréquentes à partir de 40 ans. L’hypertension intracrânienne est retrouvée chez la grande majorité des patients. Il s’agit pour la plupart d’entre-elles de tumeurs secondaires d’origine mammaire. Les tumeurs primitives sont dominées par le glioblastome.
CONFLITS D’INTERET : Les auteurs n’ont déclaré aucun conflit d’intérêts.
DECLARATIONS
Le consentement des tuteurs légaux et leur approbation ont été obtenus pour la publication de ces cas.
REFERENCES
- Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA A Cancer J Clin. 2021 May;71(3):209–49. DOI : 10.3322/caac.21660
- Cancer today [Internet]. 2021. Available from: http://gco.iarc.fr/today/home
- McNeill KA. Epidemiology of Brain Tumors. Neurologic Clinics. 2016 Nov;34(4):981–98. DOI : 10.1016/j.ncl.2016.06.014
- Tongavelona A, Randrianjisandrotra O, Ramidrsoa AL, Raobela L, Ratovondrainy W, Randrianjafisamindrakotroka NS. Les tumeurs du système nerveux central à Antananarivo Madagascar. African Journal of Neurological Sciences. 2019;38(1):28–37.
- Miller KD, Ostrom QT, Kruchko C, Patil N, Tihan T, Cioffi G, et al. Brain and other central nervous system tumor statistics, 2021. CA A Cancer J Clin. 2021 Sep;71(5):381–406. DOI : 10.3322/caac.21693
- Wells EM, Packer RJ. Pediatric Brain Tumors: CONTINUUM: Lifelong Learning in Neurology. 2015 Apr;21:373–96. DOI : 10.1212/01.CON.0000464176.96311.d1
- Motah M, Gams Massi D, Fouda Bekolo F, Akweseh Nju N, Ndoumbe A, Moumi M, et al. Epidemiological profile of brain tumors in Cameroon: a retrospective study. Egypt J Neurol Psychiatry Neurosurg. 2021 Dec;57(1):126. DOI : 10.1186/s41983-021-00381-6
- Ndubuisi CA, Ohaegbulam SC, Iroegbu LU, Ekuma ME, Mezue WC, Erechukwu UA. Histologically Confirmed Intracranial Tumors Managed at Enugu, Nigeria. Journal of Neurosciences in Rural Practice. 2017 Oct;08(04):585–90. DOI : 10.4103/jnrp.jnrp_155_17
- Andrews N, Ramesh R, Odjidja T. A preliminary survey of central nervous system tumors in Tema, Ghana. West African Journal of Medicine. 2004 Mar 18;22(2):167–72. DOI : 10.4314/wajm.v22i2.27942
- Leece R, Xu J, Ostrom QT, Chen Y, Kruchko C, Barnholtz-Sloan JS. Global incidence of malignant brain and other central nervous system tumors by histology, 2003–2007. Neuro-Oncology. 2017 Oct 19;19(11):1553–64. DOI : 10.1093/neuonc/nox091
- Ostrom QT, Patil N, Cioffi G, Waite K, Kruchko C, Barnholtz-Sloan JS. CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2013–2017. Neuro-Oncology. 2020 Oct 30;22(Supplement_1):iv1–96. DOI : 10.1093/neuonc/noaa200
- Jiang T, Tang G, Lin Y, Peng X, Zhang X, Zhai X, et al. Prevalence estimates for primary brain tumors in China: a multi-center cross-sectional study. Chin Med J (Engl). 2011 Sep;124(17):2578–83.
- Mondal S, Pradhan R, Pal S, Biswas B, Banerjee A, Bhattacharyya D. Clinicopathological pattern of brain tumors: A 3-year study in a tertiary care hospital in India. Clin Cancer Investig J. 2016;5(5):437. DOI : 10.4103/2278-0513.197861
- Drappatz J. Medical Care of Patients With Brain Tumors. CONTINUUM: Lifelong Learning in Neurology. 2012;18:275–94.
- Butowski NA. Epidemiology and Diagnosis of Brain Tumors. CONTINUUM: Lifelong Learning in Neurology. 2015;21:301–13.
- Kirby S, Purdy RA. Headaches and Brain Tumors. Neurologic Clinics. 2014 May;32(2):423–32. DOI : 10.1016/j.ncl.2013.11.006
- Vecht CJ, Kerkhof M, Duran-Pena A. Seizure Prognosis in Brain Tumors: New Insights and Evidence-Based Management. The Oncologist. 2014 Jul 1;19(7):751–9. DOI : 10.1634/theoncologist.2014-0060
- Klinger NV, Shah AK, Mittal S. Management of brain tumor-related epilepsy. Neurol India. 2017;65(Supplement):S60–70. DOI : 10.4103/neuroindia.NI_1076_16
- Leung D, Han X, Mikkelsen T, Nabors LB. Role of MRI in Primary Brain Tumor Evaluation. J Natl Compr Canc Netw. 2014 Nov;12(11):1561–8. DOI : 10.6004/jnccn.2014.0156
- Yan P-F, Yan L, Zhang Z, Salim A, Wang L, Hu T-T, et al. Accuracy of conventional MRI for preoperative diagnosis of intracranial tumors: A retrospective cohort study of 762 cases. International Journal of Surgery. 2016 Dec;36:109–17. DOI : 10.1016/j.ijsu.2016.10.023
- Fink K, Fink J. Imaging of brain metastases. Surg Neurol Int. 2013;4(5):209. DOI : 10.4103/2152-7806.111298
- Orringer DA, Golby A, Jolesz F. Neuronavigation in the surgical management of brain tumors: current and future trends. Expert Review of Medical Devices. 2012 Sep;9(5):491–500. DOI : 10.1586/erd.12.42
- Jung T-Y, Jung S, Kim I-Y, Park S-J, Kang S-S, Kim S-H, et al. Application of Neuronavigation System to Brain Tumor Surgery with Clinical Experience of 420 Cases. Minim Invasive Neurosurg. 2006 Aug;49(4):210–5. DOI : 10.1055/s-2006-948305
- Thiam AB, Mbaye M, Thioub M, Kala RGB, Sy EHCN, Faye M, et al. Brain Metastases: Epidemiological, Clinical, Diagnosis, Treatment and Outcome Features in Dakar. OJMN. 2019;09(04):410–8. DOI : 10.4236/ojmn.2019.94038
- Collomb H, Dumas M, Girard PL. Processus expansifs intracrâniens chez le Noir au Sénégal. Journal of the Neurological Sciences. 1973 Aug;19(4):437–52. DOI : 10.1016/0022-510x(73)90041-5
- Eyenga V-C, Ngah JE, Atangana R, Etom E, Ngowe MN, Bassong Y, et al. Les tumeurs du système nerveux central au Cameroun : histopathologie, démographie. Cahiers de Santé. 2008 Jan;18(1):039–42. DOI : 10.1684/SAN.2008.0096
- Konségré V, Lamien-Sanou A, Ouédraogo AS, Ramdé WN, Traoré C, Ido F, et al. Place des méningiomes dans les tumeurs du système nerveux central au centre hospitalier universitaire Yalgado Ouédraogo (CHU-YO) de Ouagadougou : approche histopathologique. J Afr Cancer. 2014 Nov;6(4):235–9. DOI : 10.1007/s12558-014-0344-7
- Newton HB, Malkin MG. Intracranial metastases. Boca Raton: CRC Press; 2010 p. 23–39. (Neurological Complications of Systemic Cancer and Antineoplastic Therapy, 1st edition).
- Bangash MH. Incidence of brain tumors at an academic centre in Western Saudi Arabia. East African Medical Journal. 2012 Apr 4;88(4):138–42.
- Taillibert S, Le Rhun É. Épidémiologie des lésions métastatiques cérébrales. Cancer/Radiothérapie. 2015 Feb;19(1):3–9. DOI : 10.1016/j.canrad.2014.11.001
- Hecht SS. Tobacco Smoke Carcinogens and Lung Cancer. JNCI Journal of the National Cancer Institute. 1999 Jul 21;91(14):1194–210. DOI : 10.1093/jnci/91.14.1194
- Parascandola M, Xiao L. Tobacco and the lung cancer epidemic in China. Transl Lung Cancer Res. 2019 May;8(S1):S21–30. DOI : 10.21037/tlcr.2019.03.12
- Boyle P, Maisonneuve P. Lung cancer and tobacco smoking. Lung Cancer. 1995;12:167–81.
- Perez-Warnisher MT, de Miguel M del PC, Seijo LM. Tobacco Use Worldwide: Legislative Efforts to Curb Consumption. Annals of Global Health. 2019 Jan 22;85(1):9. DOI : 10.5334/aogh.2417
- Olasode BJ, Shokunbi MT, Aghadiuno PU. Intracranial neoplasms in Ibadan, Nigeria. East Afr Med J. 2000 Jan;77(1):4–8.
- Ostrom QT, Gittleman H, Stetson L, Virk SM, Barnholtz-Sloan JS. Epidemiology of Gliomas. In: Raizer J, Parsa A, editors. Current Understanding and Treatment of Gliomas [Internet]. Cham: Springer International Publishing; 2015 [cited 2022 Mar 17]. p. 1–14. (Cancer Treatment and Research; vol. 163). Available from: http://link.springer.com/10.1007/978-3-319-12048-5_1. DOI : 10.1007/978-3-319-12048-5_1
- Omuro A. Glioblastoma and Other Malignant Gliomas: A Clinical Review. JAMA. 2013 Nov 6;310(17):1842. DOI : 10.1001/jama.2013.280319
- Wirsching H-G, Galanis E, Weller M. Glioblastoma. In: Handbook of Clinical Neurology [Internet]. Elsevier; 2016 [cited 2022 Mar 17]. p. 381–97. Available from: https://linkinghub.elsevier.com/retrieve/pii/B9780128029978000232. DOI : 10.1016/B978-0-12-802997-8.00023-2