Hypofractionated palliative radiotherapy in locally advanced cancers of the upper aerodigestive tract
Radiothérapie palliative hypofractionnée dans les cancers localement avancés des voies aéro-digestives supérieures
FAC. Cheumaga1, MB. Ba1, K. Ka1, M. Mane1, N. Ndour2, PM. Diéne1, AS. Badiane3, I. Thiam3, FN. Sarr3, PM. Gaye1.
1 Centre Hospitalier National Dalal Jamm, Sénégal.
2 Centre Hospitalier National Universitaire Fann, Sénégal.
3 Hôpital Aristide Le Dantec, Sénégal.
DOI: 10.54266/ajo.2.1.29.Pk7QUa5bgP
ABSTRACT
INTRODUCTION: Upper aerodigestive tract cancers are a public health problem. They caused more than 400,000 deaths in 2020, 6% of which occurred in Africa. Many patients consult at advanced stages and the only local palliative treatment that can be considered is radiotherapy. On a very large tumor volume, it is often delivered in a short spread in hypofractionated mode. MATERIALS AND METHODS: From June 2018 to August 2021, 14 patients received hypofractionated palliative radiotherapy for locally advanced upper aerodigestive tract tumors. All had pathological confirmation of their cancers. Patients with a WHO performance status of less than or equal to two received radiotherapy at a dose of 20 to 39 Gy in five to 13 fractions. Those with an objective response received additional dose up to a total equivalent dose of 70 Gy in two Gy fractions. RESULTS: Cervical swelling and respiratory distress were the most common symptoms at diagnosis. Squamous cell carcinoma was present in 64.3% of patients and the site of origin was the hypopharynx in 42.9% of cases. Five patients showed an objective locoregional response, two of whom received additional doses. All patients presented a grade 1 or 2 radiation dermatitis and one of them presented a grade 4 radiomucositis requiring hospitalization. CONCLUSION: Hypofractionated radiotherapy is a therapeutic approach that could be proposed to patients with locally advanced upper aerodigestive tract cancers.
KEYWORDS: Cancer; Upper aerodigestive tract; Hypofractionated radiotherapy.
RESUME
INTRODUCTION : Les cancers des voies aérodigestives supérieures sont un problème de santé publique. Ils ont causé plus de 400.000 décès en 2020 dont 6% sont survenus en Afrique. De nombreux patients consultent à des stades avancés et le seul traitement palliatif local pouvant être envisagé est la radiothérapie. Sur un volume tumoral très important, elle est souvent délivrée selon un étalement court en mode hypofractionné. MATERIELS ET METHODES : De Juin 2018 à Août 2021, 14 patients ont bénéficié d’une radiothérapie palliative hypofractionnée pour des tumeurs des voies aérodigestives supérieures localement avancées. Tous ont eu une confirmation anatomopathologique de leurs cancers. Les patients avec un statut de performance OMS inférieur ou égal à deux ont bénéficié d’une radiothérapie à la dose 20 à 39 Gy en cinq à 13 fractions. Ceux ayant eu une réponse objective ont bénéficié d’un complément de dose jusqu’à une dose totale équivalente de 70 Gy en fractions de deux Gy. RESULTATS : La tuméfaction cervicale et la détresse respiratoire étaient les symptômes les plus fréquents au diagnostic. Il s’agissait de carcinome épidermoïde chez 64,3% des patients et le site d’origine était l’hypopharynx dans 42,9% des cas. Cinq patients ont présenté une réponse objective locorégionale dont deux ont bénéficié d’un complément de dose. Tous les patients ont présenté une radiodermite grade 1 ou 2 et l’un d’eux a présenté une radiomucite grade 4 nécessitant une hospitalisation. CONCLUSION : La radiothérapie hypofractionnée constitue une approche thérapeutique qui pourrait être proposée aux patients avec des cancers localement avancés des voies aérodigestives supérieures.
MOTS-CLES : Cancer ; Voies aérodigestives supérieures ; Radiothérapie hypofractionnée.
INTRODUCTION
Selon le Centre International de Recherche sur le Cancer (CIRC), les cancers des voies aérodigestives supérieures représentaient en 2020 environ 4% des 19.000.000 des nouveaux cas de cancer dans le monde. Il s’agissait par ordre décroissant du cancer des lèvres et cavité buccale (2%), du cancer du larynx (1%), du nasopharynx (0,7%), de celui de l’oropharynx (0,5%) et de celui de l’hypopharynx (0,4%). Les cancers des cavités naso-sinusiennes et de l’oreille n’étaient pas répertoriés (1). La proportion de décès par cancer des voies aérodigestives supérieures varie selon les régions du monde, elle est de 3,1 décès pour 100.000 habitants en Afrique et 2,1 décès pour 100.000 habitants au Sénégal (2). Les principaux facteurs de risque identifiés sont le tabac, l’alcool, le virus du papillome humain, le virus Epstein Barr. Le traitement de ces cancers repose sur la chirurgie, la radiothérapie et les traitements systémiques (chimiothérapie et thérapies ciblées) (3,4). Dans certains pays, la plupart des patients consulte à des stades localement avancés (5). Chez ceux-ci, un traitement curatif par chirurgie ou radiothérapie ne saurait être envisagé au regard du risque de morbidité et de mortalité. La radiothérapie hypofractionnée est souvent utilisée dans ce contexte à titre palliatif pour un contrôle local. Nous avons rapporté les données diagnostiques et thérapeutiques des patients ayant bénéficié d’une radiothérapie palliative hypofractionnée.
MATERIELS ET METHODES
Caractéristiques des patients
Nous avons mené une étude descriptive rétrospective dans le service d’Oncologie-Radiothérapie du Centre Hospitalier National Dalal Jamm à Dakar de Juin 2018 à Juin 2021. Ont été colligés les patients traités par radiothérapie selon le mode hypofractionné, pour des cancers des voies aérodigestives supérieures (VADS) confirmés histologiquement, métastatiques ou non, non résécables. Chez ceux-ci un traitement à dose curative en fractionnement classique n’avait pu être réalisé en raison d’un risque de toxicité inacceptable sur les organes à risque par la technique de radiothérapie conformationnelle tridimensionnelle, la seule disponible dans notre contexte.
Données étudiées
Les patients ont été identifiés à partir du programme informatique d’enregistrement puis les données recherchées recueillies à partir des dossiers médicaux. Il s’agissait des données suivantes pour chaque patient : caractéristiques sociodémographiques (âge et sexe), histoire clinique (statut de performance ECOG (Eastern Cooperative Oncology Group), les motifs de consultation, signes cliniques au diagnostic et le délai entre le diagnostic de la tumeur primitive et celui des métastases), caractéristiques radiologiques (topographie de la lésion et la classification TNM de la 8ème édition de l’Union Internationale Contre le Cancer (UICC)), le type histologique, le déroulement du traitement (traitement reçu avant la radiothérapie, la dose totale et le fractionnement de radiothérapie et la réponse à la chimiothérapie et la radiothérapie selon les critères RECIST (Response Evaluation Criteria in Solid Tumors)) et le suivi (la toxicité et la survie). Les données manquantes avaient été recueillies par un contact téléphonique.
Radiothérapie externe
Le traitement a été délivré selon une technique conformationnelle tridimensionnelle par deux accélérateurs linéaires de type Elekta SynergyTM de six MEV et 10 MEV.
RESULTATS
Caractéristiques démographiques et cliniques Les données démographiques, cliniques et paracliniques des patients sont présentées dans le tableau I.
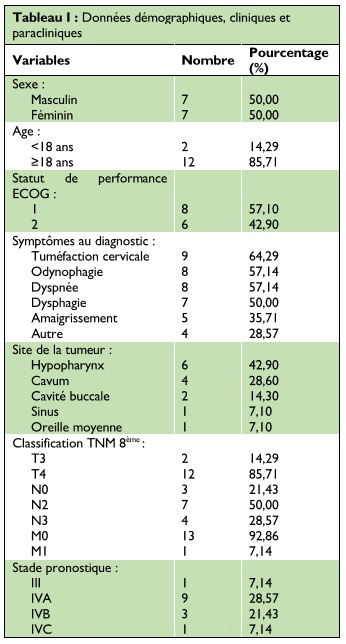
L’âge des patients variait de 14 à 71 ans avec une moyenne de 41,36 ans. Il s’agissait de sept hommes et sept femmes. La symptomatologie au diagnostic était dominée par la tuméfaction cervicale, l’odynophagie, la dyspnée et la dysphagie. Tous les patients avaient bénéficié de biopsies et d’un bilan d’imagerie avant le traitement, il s’agissait d’une tomodensitométrie cervico-faciale et thoracique. La tumeur primitive avait son origine au niveau de l’hypopharynx dans 42,9% des cas. Les patients avaient pour la majorité des tumeurs de stade IV (92,86%). L’analyse des données histologiques a retrouvé un carcinome épidermoïde dans 57,1% des cas. Celles-ci sont résumées dans le tableau II.
Déroulement du traitement
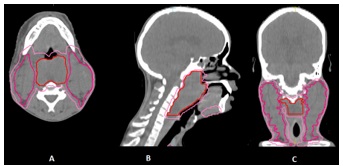
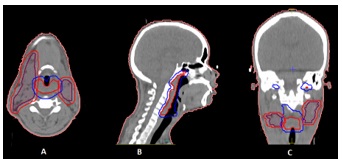
Un traitement par chimiothérapie d’induction a été initié chez 10 patients, il s’agissait de combinaisons à base de sels de platine regroupant deux à trois molécules. Quatre patients ont eu une réponse partielle et six, une stabilisation de la maladie. Une technique de radiothérapie conformationnelle tridimensionnelle a été utilisée chez tous les patients. Un scanner de simulation de radiothérapie a ainsi été réalisé afin de planifier le traitement (Figure 1).
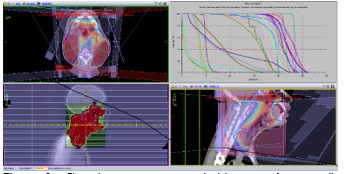
La planification dosimétrique a permis d’obtenir un plan de traitement couvrant les volumes cibles tout en respectant les contraintes dosimétriques sur les organes à risque (Figure 2).
La dose totale la plus utilisée était de 39 Gy en 13 fractions, cinq jours par semaine chez 12 patients (85,72%), la dose totale de 30 Gy en 10 fractions chez un patient (7,14%) et la dose totale de 20 Gy en cinq fractions chez un patient (7,14%). Trois faisceaux d’irradiation ont été utilisés chez deux patients, quatre faisceaux chez quatre patients, cinq faisceaux chez cinq patients, six faisceaux chez deux patients et neuf faisceaux chez un patient.
Toxicité du traitement et évolution
Les complications du traitement de radiothérapie ont été marquées par la survenue d’une radiodermite grade 1 ou grade 2 chez l’ensemble des patients, ainsi que d’une radiomucite grade 1 ou grade 2. Un patient a développé une radiomucite grade 4 en fin de traitement nécessitant une hospitalisation. Dans notre étude, cinq patients (37,71%) ont eu une réponse objective à la radiothérapie dans leur suivi. Cette réponse était caractérisée par une amélioration de la dysphagie, de l’odynophagie et la régression des adénopathies cervicales. Parmi ceux-ci, deux ont bénéficié d’un complément de dose pour obtenir au final un équivalent de dose de 70 Gy en fractions de deux Gy. Un nouveau scanner de simulation de radiothérapie a été réalisé à cet effet (Figure 3).
La durée moyenne entre la 1ère séquence de traitement et le complément de dose était de quatre mois et demi. La survie moyenne des patients répondeurs après le traitement de radiothérapie était de 8,4 mois. Au final, sept patients (87,5%), quatre patients (50%) et deux patients (25%) étaient vivants respectivement à trois mois, six mois et un an après la fin du traitement de radiothérapie.
DISCUSSION
La stratégie thérapeutique des cancers localement avancés des VADS repose sur l’utilisation de trois modalités thérapeutiques : la chirurgie, la radiothérapie et la chimiothérapie. Celles-ci peuvent être associées ou non en fonction de la localisation et du stade tumoral (6,7). Plus de 60% des patients avec des cancers des VADS se présentent à des stades III ou IV pour lesquels le risque de récidive locale et à distance est important et le pronostic sombre (8). Dans ce cadre Lee et al (9) avaient trouvé les cancers de l’oropharynx, de la cavité buccale et de l’hypopharynx dans respectivement 43%, 24% et 14% des cas. Le cancer de l’hypopharynx était majoritaire dans notre série. Ceci est probablement lié à son évolution insidieuse et son caractère lymphophile, à cela s’ajoute le statut socio-économique des patients qui est à l’origine de consultations tardives. La symptomatologie initiale peut-être différente selon les localisations mais nous retrouvons la douleur, la dysphagie, l’enrouement de la voix et la détresse respiratoire dans respectivement 96%, 32%, 22% et 20% des cas (10). Dans notre série, les symptômes les plus fréquents au diagnostic étaient la tuméfaction cervicale, l’odynophagie, la dyspnée et la dysphagie. La radiothérapie fait partie de la stratégie thérapeutique de prise en charge des cancers des VADS. Le traitement à dose totale classique s’étale généralement sur six à sept semaines et celui-ci est délivré en fractions de deux Gy (11–15). Le fractionnement idéal à utiliser pour la radiothérapie palliative n’est pas consensuel. Chez les patients en bon état général un traitement intensif est optimal d’autant plus que le contrôle local et la réponse tumorale augmentent avec la dose de rayonnement utilisée. Mais chez les patients avec des tumeurs localement avancées, non résécables et pour lesquels le pronostic à court terme est sombre, le schéma hypofractionné est souvent proposé. Les doses totales de celui-ci varient de 14,8 Gy à 60 Gy en trois à 20 fractions et en un ou trois cycles. Les taux de réponse, quant à eux, varient de 40 à 80% parfois au-delà. Pour ce qui est des toxicités, nous retrouvons généralement moins de 30 à 40% de grade 3, avec moins de 5% de grade 4 et aucune toxicité de grade 5 (16–18). Cette toxicité est dominée par la mucite et la dermite oropharyngée (19).
Une partie des patients ayant reçu un traitement hypofractionné présente une toxicité muqueuse plus précoce et une augmentation du taux de mucite de grade 3. La toxicité cutanée aiguë ne diffère pas selon le fractionnement. Chez le peu de patients qui survivent, les toxicités tardives sont identiques (20). Dans notre étude, tous les patients ont développé une radiodermite de grade 1 ou 2 et un patient a développé une radiomucite de grade 4. L’incidence et la gravité des toxicités muqueuse et cutanée de la radiothérapie avec modulation d’intensité sont moins importantes que celles causées par la technique de radiothérapie conformationnelle tridimensionnelle (21). Dans notre série, la technique de radiothérapie avec modulation d’intensité n’étant pas disponible, une radiothérapie conformationnelle tridimensionnelle avait été utilisée. Les patients présentent généralement une diminution de la douleur au-delà de 50%, ainsi qu’une amélioration de la dysphagie, de l’enrouement de la voix, du soulagement de la dyspnée et une régression de la taille des adénopathies cervicales (22). Porceddu et al (23) avaient trouvé une durée moyenne avant progression de 3,9 mois ainsi qu’une amélioration globale de la qualité de vie de la majorité des patients. Dans notre étude, 37,71% des patients ont présenté une réponse objective avec diminution de la dysphagie, de l’odynophagie et de la taille des adénopathies cervicales. Dans leur étude menée sur des patients porteurs de cancers des VADS ayant bénéficié de soins de support et pas de traitement oncologique spécifique, Kowalski et al (24) avaient montré que 55,6% et 42,3% des patients porteurs de cancers de stade III étaient vivants à six mois et un an respectivement 56,9% et 24,1% des patients avec des tumeurs de stade IV étaient vivants à six mois et un an respectivement. La survie des patients à six mois était de 47,1%, 44,4%, 36%, 32%, 30,9% pour les tumeurs des lèvres, du larynx, de la cavité buccale, de l’hypopharynx et de l’oropharynx respectivement. A un an, le taux de survie le plus bas concernant les patients atteints de cancer de l’hypopharynx (12%). Ces résultats sont proches de ceux rapportés dans notre série dans laquelle 50% et 25% des patients étaient toujours vivants à six mois et un an respectivement après la fin du traitement de radiothérapie.
CONCLUSION
Le pronostic à court et moyen terme des patients avec des cancers localement avancés des voies aérodigestives supérieures est sombre. L’objectif de la prise en charge dans ce contexte est d’obtenir un contrôle local afin d’améliorer la qualité de vie. Chez de tels patients, la radiothérapie hypofractionnée permet d’améliorer la symptomatologie clinique au prix d’une toxicité aiguë acceptable.
CONFLITS D’INTERET : Les auteurs n’ont déclaré aucun conflit d’intérêts.
DECLARATIONS
Le consentement des tuteurs légaux et leur approbation ont été obtenus pour la publication de ces cas.
REFERENCES
- Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA A Cancer J Clin. 2021 May;71(3):209–49. DOI : 10.3322/caac.21660
- Global Cancer Observatory. International Agency for Research on Cancer [Internet]. Cancer today. 2021 [cited 2021 Dec 17]. Available from: https://gco.iarc.fr/today/fact-sheets-populations
- Galbiatti ALS, Padovani-Junior JA, Maníglia JV, Rodrigues CDS, Pavarino ÉC, Goloni-Bertollo EM. Head and neck cancer: causes, prevention and treatment. Brazilian Journal of Otorhinolaryngology. 2013 Mar;79(2):239–47. DOI : 10.5935/1808-8694.20130041
- Marur S, Forastiere AA. Head and Neck Cancer: Changing Epidemiology, Diagnosis, and Treatment. Mayo Clinic Proceedings. 2008 Apr;83(4):489–501. DOI : 10.4065/83.4.489
- Mathur P, Sathishkumar K, Chaturvedi M, Das P, Sudarshan KL, Santhappan S, et al. Cancer Statistics, 2020: Report From National Cancer Registry Programme, India. JCO Global Oncology. 2020 Nov;(6):1063–75. DOI : 10.1200/GO.20.00122
- Colevas AD, Yom SS, Pfister DG, Spencer S, Adelstein D, Adkins D, et al. NCCN Guidelines Insights: Head and Neck Cancers, Version 1.2018. J Natl Compr Canc Netw. 2018 May;16(5):479–90. DOI : 10.6004/jnccn.2018.0026
- Marur S, Forastiere AA. Head and Neck Squamous Cell Carcinoma: Update on Epidemiology, Diagnosis, and Treatment. Mayo Clinic Proceedings. 2016 Mar;91(3):386–96. DOI : 10.1016/j.mayocp.2015.12.017
- Chow LQM. Head and Neck Cancer. Longo DL, editor. N Engl J Med. 2020 Jan 2;382(1):60–72. DOI : 10.1056/NEJMra1715715
- Lee Y-G, Kang EJ, Keam B, Choi J-H, Kim J-S, Park KU, et al. Treatment strategy and outcomes in locally advanced head and neck squamous cell carcinoma: a nationwide retrospective cohort study (KCSG HN13–01). BMC Cancer. 2020 Dec;20(1):813. DOI : 10.1186/s12885-020-07297-z
- Paliwal R, Kumar-Patidar A, Walke R, Hirapara P, Jain S, Raj-Bardia M. Palliative Hypo-fractionated Radiotherapy in Locally Advanced Head and Neck Cancer with Fixed Neck Nodes. Iran J Cancer Prev. 2012;5(4):178–82.
- Servagi Vernat S, Tochet F, Vieillevigne L, Pointreau Y, Maingon P, Giraud P. Radiothérapie des cancers de l’oropharynx. Cancer/Radiothérapie. 2016 Sep;20:S110–5. DOI : 10.1016/j.canrad.2016.07.017
- Pointreau Y, Lafond C, Trémolières P, Legouté F, Servagi-Vernat S, Giraud P, et al. Radiothérapie des cancers de l’hypopharynx. Cancer/Radiothérapie. 2016 Sep;20:S126–30. DOI : 10.1016/j.canrad.2016.07.020
- Pointreau Y, Lafond C, Legouté F, Trémolières P, Servagi-Vernat S, Giraud P, et al. Radiothérapie des cancers du larynx. Cancer/Radiothérapie. 2016 Sep;20:S131–5. DOI : 10.1016/j.canrad.2016.07.018
- Lapeyre M, Biau J, Racadot S, Moreira JF, Berger L, Peiffert D. Radiothérapie des cancers de la cavité buccale. Cancer/Radiothérapie. 2016 Sep;20:S116–25. DOI : 10.1016/j.canrad.2016.07.002
- Lee AW, Ng WT, Pan JJ, Poh SS, Ahn YC, AlHussain H, et al. International guideline for the delineation of the clinical target volumes (CTV) for nasopharyngeal carcinoma. Radiotherapy and Oncology. 2018 Jan;126(1):25–36. DOI : 10.1016/j.radonc.2017.10.032
- Williams GR, Manjunath SH, Butala AA, Jones JA. Palliative Radiotherapy for Advanced Cancers. Surgical Oncology Clinics of North America. 2021 Jul;30(3):563–80. DOI : 10.1016/j.soc.2021.02.007
- Grewal AS, Jones J, Lin A. Palliative Radiation Therapy for Head and Neck Cancers. International Journal of Radiation OncologyBiologyPhysics. 2019 Oct;105(2):254–66. DOI : 10.1016/j.ijrobp.2019.05.024
- Shahid Iqbal M, Kelly C, Kovarik J, Goranov B, Shaikh G, Morgan D, et al. Palliative radiotherapy for locally advanced non-metastatic head and neck cancer: A systematic review. Radiotherapy and Oncology. 2018 Mar;126(3):558–67. DOI : 10.1016/j.radonc.2017.12.011
- Mohanti BK, Umapathy H, Bahadur S, Thakar A, Pathy S. Short course palliative radiotherapy of 20Gy in 5 fractions for advanced and incurable head and neck cancer: AIIMS study. Radiotherapy and Oncology. 2004 Jun;71(3):275–80. DOI : 10.1016/j.radonc.2004.03.009
- Weissberg JB, Pillsbury H, Sasaki CT, Son YH, Fischer JJ. High Fractional Dose Irradiation of Advanced Head and Neck Cancer: Implications for Combined Radiotherapy and Surgery. Archives of Otolaryngology – Head and Neck Surgery. 1983 Feb 1;109(2):98–102. DOI : 10.1001/archotol.1983.00800160032008
- Spiotto MT, Weichselbaum RR. Comparison of 3D Confromal Radiotherapy and Intensity Modulated Radiotherapy with or without Simultaneous Integrated Boost during Concurrent Chemoradiation for Locally Advanced Head and Neck Cancers. Camphausen K, editor. PLoS ONE. 2014 Apr 8;9(4):e94456. DOI : 10.1371/journal.pone.0094456
- Rasha Hamdy H. Brief palliative radiotherapy course for advanced and incurable head and neck cancer. Int J Radiol Radiat Oncol. 2018 Jul 16;014–8. DOI : 10.17352/ijrro.000029
- Porceddu SV, Rosser B, Burmeister BH, Jones M, Hickey B, Baumann K, et al. Hypofractionated radiotherapy for the palliation of advanced head and neck cancer in patients unsuitable for curative treatment – “Hypo Trial”. Radiotherapy and Oncology. 2007 Dec;85(3):456–62. DOI : 10.1016/j.radonc.2007.10.020
- Kowalski LP, Carvalho AL. Natural history of untreated head and neck cancer. European Journal of Cancer. 2000 May;36(8):1032–7. DOI : 10.1016/s0959-8049(00)00054-x