Comparative study between elective nodal irradiation and involved field radiation therapy for early-stage esophageal carcinoma
Etude comparative entre l’irradiation prophylactique des ganglions et la radiothérapie du champ atteint dans le cancer de l’œsophage au stade précoce
M. Keita1,2, WB. Shen1, M. Bah2, A. Camara2, IK. Kondé2, B. Traoré2, SC. Zhu1.
1 Département de Radio-oncologie, The Fourth Hospital, Hebei Medical University, Shijiazhuang 050011, Chine.
2 Département de chirurgie oncologique du CHU – Donka, Conakry 5575, Guinée.
DOI: 10.54266/ajo.2.1.3.RxCxWHpxgo
ABSTRACT
OBJECTIVE: To analyze the feasibility of elective nodal irradiation for early-stage esophageal carcinoma, evaluate the curative effect of radiation therapy, and determine the causes of treatment failure. MATERIALS AND METHODS: Data were collected from 123 patients with esophageal cancer T1-2 N0-1 M0 stage. Patients were divided into two groups based on different types of radiotherapy. Among the 123 patients, 102 underwent involved field radiotherapy, whereas 21 received elective nodal irradiation. A comparative analysis of patients in the two groups was conducted. RESULTS: In 123 patients, the one-, three-, and five-year overall survival rates were 87.8%, 47.2%, and 36.6%, respectively. By contrast, the one-, three-, and five-year local control rates were 89.4%, 67.5%, and 48.8%, respectively. After comparing the one-, three-, and five-year survival rates in the elective nodal irradiation patients (90.5%, 47.6%, and 42.9%, respectively) with those in the involved field radiotherapy patients (86.3%, 49.0%, and 35.2%, respectively), no significant difference was found (Chi2=0.290, p=0.588). The results indicate that elective nodal irradiation possibly decreased nodal metastases (Chi2=5.778, p=0.016). CONCLUSION: Three-dimensional conformal radiotherapy is one of the best therapeutic regimens of radiation for esophageal cancer. Elective nodal irradiation is possibly effective for preventing regional nodal metastasis. Whether elective nodal irradiation leads to an improved overall survival needs further investigation.
KEYWORDS: Esophageal cancer; Three-dimensional conformal radiotherapy; Prognosis; Elective nodal irradiation; Involved field radiotherapy.
RESUME
OBJECTIF : Analyser la faisabilité de l’irradiation prophylactique des ganglions dans le cancer de l’œsophage au stade précoce, évaluer l’effet curatif de la radiothérapie et déterminer les causes de l’échec du traitement. MATERIELS ET METHODES : Les données de 123 patients atteints d’un cancer de l’œsophage classé T1-2 N0-1 M0 ont été rétrospectivement étudiées. Les patients étaient répartis en deux groupes en fonction des modalités de la radiothérapie. Parmi eux, 102 ont bénéficié d’une radiothérapie du champ atteint et 21 ont bénéficié d’une irradiation prophylactique des ganglions. Une analyse comparative dans les deux groupes a été réalisée. RESULTATS : Chez les 123 patients, les taux de survie à un, trois et cinq ans étaient respectivement de 87,8%, 47,2% et 36,6%. Les taux de contrôle local à un, trois et cinq ans étaient de 89,4%, 67,5% et 48,8%, respectivement. Les taux de survie à un, trois et cinq ans chez 21 patients traités par une irradiation prophylactique des ganglions étaient de 90,5%, 47,6% et 42,9%, contre 86,3%, 49,0% et 35,2%, respectivement chez 102 patientes traités par la radiothérapie du champ atteint. Aucune différence significative n’a été trouvée entre les deux groupes (Chi2=0,290, p=0,588). Nos résultats indiquent que l’irradiation prophylactique des ganglions diminue significativement la survenue de métastases ganglionnaires (Chi2=5,778, p=0,016). CONCLUSION : La radiothérapie conformationnelle en 3D est l’un des meilleurs schémas thérapeutiques de radiothérapie dans le cancer de l’œsophage stade précoce. L’irradiation prophylactique des ganglions serait une option pour prévenir les métastases ganglionnaires régionales. La question de savoir si l’irradiation prophylactique des ganglions conduit à une amélioration de la survie globale, les résultats de la présente étude suggèrent des enquêtes plus approfondies.
MOTS-CLES : Cancer de l’œsophage ; Radiothérapie conformationnelle tridimensionnelle ; Pronostic ; Irradiation prophylactique des ganglions ; Radiothérapie du champ atteint.
INTRODUCTION
Avec l’amélioration des méthodes d’investigation et la promotion continue du dépistage précoce, de plus en plus de cancers de l’œsophage sont diagnostiqués à un stade précoce de la maladie. Pour ces patients atteints d’un cancer de l’œsophage au stade précoce, la chirurgie reste le premier choix de traitement parmi les options thérapeutiques disponibles. Cependant, nombreux sont ces patients qui ne souhaitent pas ou ne peuvent pas se faire opérer pour diverses raisons. Récemment, les résultats des données de recherches cliniques ont démontré que la radiothérapie dans le cancer de l’œsophage au stade précoce peut obtenir de meilleurs résultats (1). En revanche, les études sur la survie à long terme des patients atteints d’un cancer de l’œsophage au stade précoce sont rares. L’objectif de ce travail était d’analyser la faisabilité de l’irradiation prophylactique des ganglions (IPG) dans le cancer de l’œsophage au stade précoce, évaluer l’effet curatif de la radiothérapie et déterminer les causes d’échec du traitement.
MATERIELS ET METHODES
D’octobre 2008 à décembre 2015, nous avons revu rétrospectivement les dossiers médicaux individuels de 123 patients consécutifs atteints de cancer de l’œsophage traités par radiothérapie exclusive ou radio-chimiothérapie conformationnelle à 3 Dimension à l’institut de cancer de Shijiazhuang, quatrième hôpital affilié à l’Université Médical de Hebei.
Critères d’éligibilité
Les critères d’éligibilité comprenaient : 1-Confirmation histologique d’un carcinome épidermoïde de l’œsophage, 2-Dossiers médicaux complets : données du transit oeso-gastrique baryté, de la tomodensitométrie (TDM) thoracique et de l’échographie ou TDM abdominale, 3-Avoir un cancer de l’œsophage classé T1-2 N0-1 M0 selon l’American Joint Commettee on Cancer (AJCC). Les patients ont été exclus s’ils avaient une tumeur maligne dans un autre site ou avaient des antécédents de traitement antérieur de cancer.
Caractéristiques cliniques de la tumeur
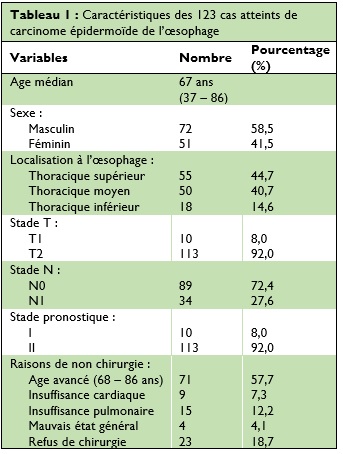
Selon les critères de la 7ème édition de l’AJCC (2010), toutes les données de la TDM thoracique avec injection de contraste et de tomographie par émission de positons (TEP)-TDM ont été examinées par au moins deux radiologues expérimentés. N0 a été défini comme absence de métastase dans les ganglions lymphatiques régionaux, tandis que N1 a été défini comme présence d’au moins un ganglion régional positif. Tous les patients étaient classés T-2 N0-1 M0, dont dix cas au stade T1, 113 cas au stade T2, 89 cas au stade N0 et 34 cas au stade N1. Il y avait dix cas au stade I et 113 cas au stade II (79 cas au stade IIA et 34 cas au stade IIB) (Tableau I).
Méthode
Selon la différence entre les champs d’irradiation, tous les patients ont été répartis entre l’IPG et la radiothérapie du champ atteint ou involved field radiotherapy (IFRT), avec ou sans chimiothérapie. Les volumes cibles : Gross Tumor Volume (GTV), Clinical Target Volume (CTV) et Planning Target Volume (PTV) ont été définis conformément au rapport N° 62 de l’International Commission on Radiation Unit (ICRU). Au total, 21 patients ont bénéficié d’une IPG dont 18 pour une tumeur localisée au niveau de l’étage thoracique supérieur, deux à l’étage thoracique moyen et un à l’étage thoracique inférieur. Le volume cible ganglionnaire a été défini comme CTV-nd. Il dépendait du siège de la tumeur primitive et était déterminé selon la classification de l’American Thoracic Association. Pour les tumeurs situées à l’étage thoracique supérieur, le CTV-nd comprenait : les aires supra-claviculaires bilatérales et les aires 2, 4, 5, 6, 7 et 8. La limite inférieure était située à 4 – 5 cm en-dessous de la carène trachéale. Pour les tumeurs situées à l’étage thoracique moyen, le CTV-nd comprenait : les aires 2, 4, 5, 6, 7 et 8. La limite inférieure correspond à la zone des ganglions lymphatiques du cardia. Pour les tumeurs situées à l’étage thoracique inférieur, le CTV-nd comprenait : le cardia, la petite courbure de l’estomac, les ganglions gastriques gauches et les aires 4, 5, 6, 7 et 8. Le volume cible planifié, défini comme PTV-nd, a été créé par extension du CTV-nd à un minimum de 0,3 – 0,5 cm latéralement et d’un à 1,5 cm longitudinalement. Avec le système de planification conformationnelle en 3D, la longueur du GTV était compris entre 1,8 – 14,7 cm, avec une longueur moyenne de six cm. Le volume cible et les organes à risques tels que la moelle épinière, la trachée, le cœur, et les poumons ont été contournés simultanément sur un scanner dosimétrique. Le traitement a été réalisé au moyen d’un accélérateur linaire type Siemens 6 MVX.
Radiothérapie
Plan de l’IPG
Les 21 patients traités par l’IPG ont d’abord reçu une dose rayonnement au PTV-nd, la dose totale de radiothérapie prescrite variait de 45,0 à 50,4 Gy en 25 à 28 fractions pour cinq à 5,3 semaines. Après la radiothérapie, le champ d’irradiation a été réduit au PTV à une dose prescrite de 10 – 20 Gy en cinq à 10 fractions sur une à deux semaines, pour une dose totale de 56 – 70 Gy, 1,8 à deux Gy par séance. La dose médiane était de 64 Gy.
Plan de l’IFRT
Les 102 autres patients ont bénéficié d’une IFRT, où IFRT correspondait au GTV et a inclut la tumeur primitive et les ganglions lymphatiques métastatiques macroscopiquement palpables visibles à l’imagerie. Avec une dose médiane de 64 Gy, la dose totale prescrite variait de 50 – 70 Gy (25 à 35 séances pendant cinq à sept semaines).
Chimiothérapie
Au total, 27 patients ont bénéficié d’une chimiothérapie dont deux avaient une tumeur au stade T1, 25 au stade T2, 19 au stade N0, huit au stade N1, deux au stade I et 25 au stade II. Le nombre de cycles de chimiothérapie était compris entre un et six. Le nombre médian de cycles de chimiothérapie était de quatre cycles. Les principaux agents cytotoxiques utilisés sont le 5-fluorouracile (800 mg/m², J 1 – 5) et le cisplatine (80 mg/m², J 1 ou 20 mg/m², J 1 – 5). La chimiothérapie séquentielle était administrée une semaine avant le début de la radiothérapie dans 21 cas. La chimiothérapie concomitante était administrée le même jour que le début de la radiothérapie, suivie d’une chimiothérapie après trois semaines dans six cas.
Effet curatif à court terme et effets indésirables de la radiothérapie
Tous les patients ont terminé avec succès le plan de traitement. Après la radiothérapie, les patients ont été revus en consultation une fois tous les un, trois et six mois, et les survivants à long terme ont été suivis au moins deux fois par an. L’évaluation de l’efficacité du traitement consistait à un examen clinique minutieux et à la réalisation d’une TDM thoracique, un transit œsophagien ou œsogastroduodénal, une échographie abdominale et d’autres examens. L’évaluation de l’efficacité à court terme a utilisé les critères de Wan et al (2). Les effets indésirables ont été évalués à l’aide des critères d’évaluation des dommages causés par les rayonnements RTOG.
Echec du traitement
La récidive dans le site primitif, la récidive des ganglions et/ou des métastases ganglionnaires régionales, la récidive dans le champ irradié et/ou hors du champ irradié étaient classées comme récidive régionale. Les métastases des organes à distance et les métastases ganglionnaires extrarégionales dans différents sites étaient classées comme métastases à distance.
Suivi
Les patients ont été suivis jusqu’au 31 Décembre 2016. Les patients en radiothérapie ont été suivis pendant 1,5 à 100 mois, avec une médiane de 33,3 mois. Cent-et-huit, 60 et 41 patients ont été suivis pendant un, trois et cinq ans, respectivement. Le taux de suivi était de 100%.
Analyse statistique
L’ensemble des données ont été saisies et analysées sur le logiciel SPSS 21.0. Les taux de survie globale et de contrôle local ont été calculés par la méthode de Kaplan-Meier, et la méthode bilatérale de Log-rank a été utilisée pour le test de signification. Le test Chi2 a permis de comparer les caractéristiques des deux groupes. Le test était significatif si p<0,05.
RESULTATS
Analyse de la survie
Avec une survie médiane de 33,3 mois, les taux de contrôle local de l’ensemble du groupe de 123 patients à un, trois et cinq ans étaient respectivement de 89,4% (110/123), 67,5% (83/123) et 48,8% (60/123). Les taux de survie globale à un, trois et cinq ans étaient respectivement de 87,8% (108/123), 47,2% (58/123) et 36,6% (45/123). Les taux de survie globale à un, trois et cinq ans pour les 21 des patients traités par l’IPG étaient respectivement de 90,5% (19/21), 47,6% (10/21) et 42,9% (9/21), contre 86,3% (88/102), 49,0% (50/102) et 35,2% (36/102) des 102 patients qui ont bénéficié de IFRT. Aucune différence significative n’a été observée entre les deux groupes (Chi2=0,290, p=0,588). En revanche, une récidive locale est survenue chez quatre des 21 patients IPG (19,0%) et chez 41 des 102 patients IFRT (40,2%), sans que la différence ne soit significative entre les deux groupes (Chi2=3,357, p=0,067). Des métastases ganglionnaires régionales et/ou des métastases à distance sont survenues chez un total de 46 patients, trois des 21 patients IPG (14,4%) et 43 des 102 patients IFRT (42,2%), avec une différence statistiquement significative entre les deux groupes (Chi2=5,778, p=0,016).
Analyse des effets indésirables
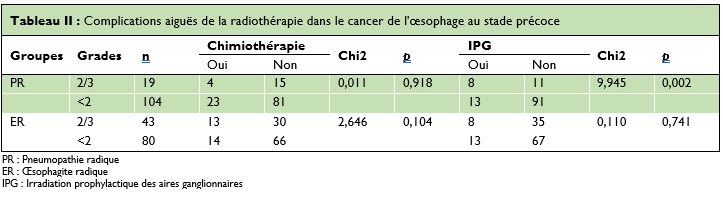
Une pneumopathie radique aiguë (PR) de grade 2/3 est survenue chez 19 (15,4%) des 123 patients. Une œsophagite radique aiguë (ER) de grade 2/3 chez 43 (35,0%) des 123 patients. Aucun effet indésirable aigu de type grade 4 n’a été observé. Cependant, bien que les différences ne soient pas significatives, les taux de PR et d’ER de grade ≥2 étaient plus élevés chez 27 patients qui ont bénéficié de la chimiothérapie (p=0,918 et 0,104). Comparés aux patients traités par IFRT, parmi les 21 patients traités IPG, huit (38,1%) patients ont présenté une PR de grade ≥2 avec une différence statistiquement significative (p=0,002). En revanche, nous n’avons pas trouvé de différence significative en termes d’ER, huit (38,1%) comparés aux 102 patients traités par IFRT (p=0,741), (Tableau II).
Analyse des causes de décès et d’échec de traitement après radiothérapie
Au terme du suivi, 92 patients sur 123 étaient décédés, les principales causes de décès étaient en rapport avec la récidive locale et les métastases à distance (Tableau III).

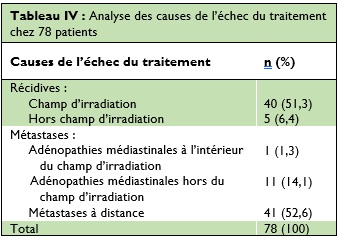
Soixante-dix-huit patients ont présenté un échec thérapeutique, les principales causes de l’échec du traitement étaient liées à une récidive et/ou à des métastases (Tableau IV).
DISCUSSION
Le taux de détection précoce du cancer de l’œsophage en pratique clinique a considérablement augmenté avec l’amélioration des moyens d’investigation et de prise en charge. Ganesamoni et al (3) ont rapporté des taux de survie à cinq ans des patients atteints de cancer de l’œsophage de stade I et II traités par chirurgie seule de 47,5% et 37,7%, respectivement. Parmi eux, le taux de survie à cinq ans pour le cancer de l’œsophage thoracique supérieur de stade II était de 20%. Mais au même moment, les auteurs affirmaient que la chirurgie radicale du cancer de l’œsophage était associée à des complications postopératoires graves, telles que les infections pulmonaires, les fuites anastomotiques, etc., et que le taux de mortalité périopératoire peut atteindre les 3%. De nos jours, environ 30% des patients atteints de cancers de l’œsophage bénéficient d’une chirurgie d’exérèse radicale dans la pratique clinique en raison d’autres comorbidités sous-jacentes, de l’âge et/ou du souhait du patient. Les résultats des données de recherches cliniques montrent que le taux de survie à cinq ans des patients atteints de cancer de l’œsophage stade I traités par radiothérapie exclusive varie de 36 à 84% (4). L’efficacité de la radiothérapie dans le cancer de l’œsophage a été confirmée dans les années 1980. L’essai RTOG85-01 a suggéré que la radio-chimiothérapie devrait être un standard dans le traitement des patients atteints d’un cancer de l’œsophage récusés par la chirurgie (5). Yagi et al (6) ont rapporté dans une série de 72 patients atteints d’un cancer de l’œsophage stade I traités par radio-chimiothérapie un taux de survie globale et de survie sans tumeur à quatre ans de 81% et 53%, respectivement. Kawaguchi et al (7) ont aussitôt rapporté dans une étude de 68 patients atteints d’un cancer de l’œsophage stade I traités par radiothérapie exclusive un taux de survie globale à trois ans et de survie sans maladie de 76% et 66%, respectivement. Dans la présente étude, 10 patients avaient un cancer de l’œsophage au stade I, et le taux de survie globale à trois et cinq ans étaient de 80,0% (8/10) et 60,0% (6/10), soit des résultats similaires à ceux rapportés par Kawaguchi et al (7). Il est évident que les métastases ganglionnaires infracliniques ou micro-métastases ganglionnaires sont un indicateur important qui affecte le pronostic des patients. Bien que la radio-chimiothérapie concomitante soit connue pour améliorer le taux de survie des patients cependant, l’impact de la chimiothérapie concomitante sur les micro-métastases ganglionnaires dans le cancer de l’œsophage reste encore très incertain. Son efficacité réside dans l’effet radio-sensibilisateur des médicaments de chimiothérapie.
La radiothérapie à champ étendu aux ganglions lymphatiques ou l’IPG apporte des avantages comme la réduction de la survenue des métastases dans les ganglions lymphatiques, en particulier les métastases ganglionnaires régionales. De nos jours, il n’existe pas de consensus clair quant à la nécessité de l’IPG pour les patients atteints d’un cancer de l’œsophage stade précoce. Les études cliniques publiées sur la chirurgie du cancer de l’œsophage (8) démontrent que le curage des ganglions lymphatiques par trois voies d’abord réduit de manière significative le taux de survenue de métastases ganglionnaires postopératoires grâce à la résection des ganglions lymphatiques locaux et des métastases infracliniques. Sur cette base, nous avons mené une étude sur l’IPG en dépits des difficultés observées dans le recrutement des cas, très peu de patients ont bénéficié de l’IPG dans la présente étude. Onozawa et al (9) ont mené une étude sur 102 patients atteints d’un cancer de l’œsophage à différents stades de la maladie, les résultats de l’étude ont montré que seul un patient ayant bénéficié de l’IPG avait présenté une récidive. Les résultats de la présente étude suggèrent que si l’IPG est un standard dans le cancer de l’œsophage localement avancé en raison de leur taux élevé de métastases ganglionnaires, son rôle dans le cancer de l’œsophage au stade précoce en raison du faible taux de métastases ganglionnaires nécessite des études plus approfondies. Li et al (10) ont rapporté dans une étude de 106 patients atteints d’un cancer superficiel de l’œsophage traités par l’IPG un taux de récidive de 6% en dehors du champ d’irradiation, et seulement 1% des patients avaient une récidive dans le champ d’irradiation. Ishikawa et al (11) ont analysé les résultats de traitement de 68 patients atteints d’un cancer de l’œsophage stade I à la recherche de récidives et ont trouvé que seuls 2% des patients avaient développé des métastases ganglionnaires en dehors de la zone du champ irradié. Dans notre étude, sur les 21 patients traités par l’IPG, aucun n’a présenté une récidive locale ou une métastase ganglionnaire dans le champ irradié. A notre connaissance, il n’existe pas encore de publication sur la question de savoir si oui l’IPG peut améliorer la survie à long terme des patients atteints de cancer de l’œsophage stade précoce. Ma et al (12) ont publié les données d’une étude sur une série de 102 patients consécutifs atteints d’un cancer de l’œsophage cervical et thoracique supérieur et ont conclu que pour les patients atteints de cancers de l’œsophage, si l’IFRT diminue considérablement effets secondaires aigus de l’irradiation, elle n’augmente pas à cet effet de manière significative le taux d’échec thérapeutique dans les ganglions. Pour Ji et al (13), cela pourrait s’expliquer par une extension infraclinique hors champ irradié des cancers de l’œsophage traités par IFRT, ce qui fait que la zone de drainage des ganglions lymphatiques adjacents a reçu la dose de rayonnement correspondante. Cette partie de la dose peut jouer un certain rôle dans le contrôle des métastases infracliniques du cancer de l’œsophage, réduisant du coût le taux d’échec de traitement des ganglions lymphatiques dans le champ irradié. Dans la présente étude, nos résultats ont également montré que la différence entre le taux de survie globale et le taux de contrôle local des patients traités par l’IPG n’était pas significative par rapport à ceux traités par IFRT, et que l’incidence des effets indésirables était plus élevée que dans le dernier groupe. Pengqin et al (14) trouvent également qu’il peut être possible d’irradier de la même manière la tumeur primitive et les ganglions lymphatiques positifs. Une analyse plus approfondie de ce groupe de patients a montré que par rapport aux patients traités par IFRT, le taux de métastases ganglionnaires régionales chez les patients traités par l’IPG était significativement réduit, ce résultat est cohérent avec les données publiées par Su et al (15). Cette étude estime que l’IGP chez les patients atteints d’un cancer de l’œsophage stade précoce peut réduire de manière significative les métastases ganglionnaires régionales en éliminant les micro-métastases.
En Guinée, on estime à 13,8% le pourcentage de cancers urologiques dans les deux sexes [4]. Cependant la fréquence des cancers urologiques nous paraît sous-estimée à cause de l’absence de confirmation anatomopathologique chez 30 patients dans cette étude. Toutefois avec 2,3%, on peut considérer que les cancers urologiques constituaient un motif relativement fréquent de consultation dans notre unité. Cette fréquence est inférieure à celle trouvé dans les services d’urologie du Togo et du Bénin qui étaient de 14,7% et 17,38% respectivement [10, 11]. Cette différence serait liée au fait que les services d’urologie soient des centres de référence pour la prise en charge des cancers urologiques tant que ceux-ci ne sont pas métastatiques. La majorité des patients qui ont été orientés par le service d’urologie dans notre unité étaient à des stades métastatiques ou localement avancés.
Contrairement aux statistiques des services d’urologie [10, 11] et celui du registre de cancer [4], le cancer du rein était le premier cancer urologique dans notre étude. Cette fréquence élevée de cancer du rein était due à la prise en charge à la fois des cancers du rein de l’enfant et de celui de l’adulte dans notre unité. Dans la majorité des cas, le cancer du rein est un cancer relativement rare et vient au troisième rang des cancers urologiques après celui de la prostate et de la vessie [10, 12]. Son incidence serait forte en Amérique du Nord, en Europe occidentale, dans les pays scandinaves et en Australie ; en revanche, elle est faible en Asie et en Afrique [13]. Tossou et al [14] estimaient leur fréquence à Dakar à 1,10% de l’ensemble des cancers. L’âge moyen de 23,5 ans avec des extrêmes allant de deux à 74 ans est superposable à celui d’une étude réalisée en RCI avec une moyenne d’âge de 25,52 ans avec des extrêmes allant d’un à 67 ans [5]. Les carcinomes à cellules claires étaient plus fréquents chez l’adulte dans notre étude alors que chez l’enfant, le néphroblastome était le type histologique avec un âge compris entre trois et neuf ans. Le néphroblastome est l’un des cancers les plus fréquent de l’enfant ; il représente le troisième cancer de l’enfant au Mali [15].
Le cancer de la prostate était le second cancer dans notre étude contrairement aux données du service d’urologie de l’Hôpital National Ignace Deen, du registre de cancer de Guinée et même des pays occidentaux qui mettent le cancer de la prostate au premier rang [4, 7, 14]. Les patients étaient âgés avec une moyenne de 68,9 ans, proche de 70,3 ans pour les patients suivis au service d’urologie de l’Hôpital National Ignace Deen [7]. Selon Boyle et al, c’est le cancer le plus fréquent chez l’homme de plus de 50 ans [16] et sa fréquence augmente avec l’âge [17]. Le dosage du PSA est important dans la démarche diagnostique bien qu’il ne soit pas un marqueur spécifique du cancer prostatique [18]. Il s’agissait souvent d’adénocarcinomes fréquemment rapportés [19-21]. Les patients étaient admis à des scores pronostic élevés et à des stades métastatiques, ce qui dénote un pronostic très sombre des patients reçus dans notre unité. Le cancer de la prostate est souvent de bon pronostic à condition que le diagnostic soit précoce et le traitement proposé soit adéquat.
Les tumeurs de la vessie représentent la septième cause de décès par cancer chez l’homme et la dixième chez la femme [19]. En Afrique, les pays du Maghreb et d’Afrique de l’Ouest enregistrent les incidences les plus élevées [11, 22, 23]. Dans cette étude, le cancer de la vessie occupe la troisième place des cancers urologiques avec 20%, similaires à la fréquence de 23% au Sénégal rapportée par Dangou et al [24]. L’âge moyen de 41,8 ans est inférieur aux données rapportées par Ouattara et al [11] au Bénin qui avaient rapporté un âge moyen de 49,7 ans. L’âge moyen des cancers de la vessie est très avancé, entre 69 et 71 ans en France [25]. Nous avons noté une prédominance masculine comme rapportée au par Darré et al [10] au Togo. Le carcinome urothélial était le type histologique prédominant contrairement à une étude menée au Sénégal où le carcinome épidermoïde était le type histologique le plus fréquent [26]. La différence avec le Sénégal est liée à la prévalence élevée du carcinome épidermoïde en zone d’endémie bilharzienne au niveau des zones où existent des aménagements hydroagricoles.
Le cancer du testicule est l’un des rares cancers urologiques, représentant environ 1% de l’ensemble des cancers et reste le plus fréquent des cancers de l’homme jeune [19, 27]. Dans notre étude, deux étaient âgés de plus de 50 ans avec une moyenne d’âge de 41 ans. Les données recueillies dans les pays en voies de développement sont encore très parcellaires, mais elles semblent confirmer que les hommes d’appartenance ethniques noire ou asiatique présentent une incidence du cancer du testicule plus faible que ceux d’appartenance ethnique blanche. Les tumeurs germinales séminomateuses sont les types histologiques le plus rencontrés pour le cancer du testicule [28]. Il en était de même dans notre étude où tous les patients avaient une tumeur germinale des testicules.
Les cancers du pénis sont réputés être rare dans la littérature, et les séries publiés sont sporadiques [29]. Il touche le plus souvent l’homme après 50 ans [30]. L’âge de 61 ans retrouvé dans notre étude est inférieur à celui retrouvé dans une étude réalisée au service d’urologie et andrologie qui était de 70 ans [31]. En dehors des lésions bénignes du pénis représentées par les condylomes, les cancers du pénis sont la deuxième néoformation de la verge la plus observée et sont tous des carcinomes de type épidermoïdes [32, 33] comme dans notre étude.
Les cancers de l’urètre sont des tumeurs rares (moins de 1%) des cancers [24]. Nous avons trouvé un seul cas de carcinome urothélial en 11 ans. C’est un cancer du sujet âgé et plus fréquent chez les femmes [13]. Le carcinome urothélial était le type histologique retrouvé.
CONCLUSION
La radiothérapie conformationnelle tridimensionnelle peut être une option de traitement efficace pour les patients atteints d’un cancer l’œsophage au stade précoce. L’administration de la chimiothérapie peut réduire le taux de métastases chez ces patients, améliorant ainsi le taux de survie globale des patients. Cependant, cela mérite une analyse plus approfondie des cas. L’IPG dans le cancer de l’œsophage au stade précoce peut réduire le taux de métastases ganglionnaires par rapport aux patients traités par IFRT, mais sa capacité à améliorer le taux de survie globale des patients reste à étudier.
CONFLITS D’INTERET : Les auteurs n’ont déclaré aucun conflit d’intérêts.
DECLARATIONS
Les auteurs remercient leurs collègues pour leur soutien et leur aide continus, ainsi que leurs patients pour leur coopération.
Les auteurs remercient la Fondation des Sciences Naturelles de la province du Hebei (H2021206429) pour leur aide financière.
Un consentement éclairé est obtenu des participants en présence de témoins au moins neutres.
REFERENCES
- Xu Y, Liu J, Du X, Sun X, Zheng Y, Chen J, et al. Prognostic impact of postoperative radiation in patients undergoing radical esophagectomy for pathologic lymph node positive esophageal cancer. Radiat Oncol. 2013 Dec;8(1):116. DOI : 10.1186/1748-717X-8-116
- Wan J, Xiao A, Gao S, Guo B, Wang Y, Zhou D. Evaluation criteria for short-term efficacy of esophageal cancer after radiotherapy. China Radiation Oncology. 1989;3(4):205–7.
- Ganesamoni S, Krishnamurthy A. Three-Field Transthoracic Versus Transhiatal Esophagectomy in the Management of Carcinoma Esophagus—a Single-Center Experience with a Review of Literature. J Gastrointest Canc. 2014 Mar;45(1):66–73. DOI : 10.1007/s12029-013-9562-y
- Uchinami Y, Myojin M, Takahashi H, Harada K, Shimizu S, Hosokawa M. Prognostic factors in clinical T1N0M0 thoracic esophageal squamous cell carcinoma invading the muscularis mucosa or submucosa. Radiat Oncol. 2016 Dec;11(1):84. DOI : 10.1186/s13014-016-0660-4
- Cooper JS, Guo MD, Herskovic A, Macdonald JS, Martenson, Jr JA, Al-Sarraf M, et al. Chemoradiotherapy of Locally Advanced Esophageal Cancer: Long-term Follow-up of a Prospective Randomized Trial (RTOG 85-01). JAMA [Internet]. 1999 May 5 [cited 2022 Mar 16];281(17). Available from: http://jama.jamanetwork.com/article.aspx?doi=10.1001/jama.281.17.1623. DOI : 10.1001/jama.281.17.1623
- Yagi K, Toriumi T, Aikou S, Yamashita H, Seto Y. Salvage treatment after definitive chemoradiotherapy for esophageal squamous cell carcinoma. Ann Gastroenterol Surg. 2021 Jul;5(4):436–45. DOI : 10.1002/ags3.12448
- Kawaguchi Y, Nishiyama K, Miyagi K, Suzuki O, Ito Y, Nakamura S. Patterns of Failure Associated with Involved Field Radiotherapy in Patients with Clinical Stage I Thoracic Esophageal Cancer. Japanese Journal of Clinical Oncology. 2011 Aug 1;41(8):1007–12. DOI : 10.1093/jjco/hyr069
- Mao Y, He J, Dong J, Cheng G, Sun K, Liu X, et al. The left and right thoracic approach for thoracic esophageal cancer dissection of lymph node nodes Fruit comparison. Chinese Journal of Oncology. 2012;34(4):296–300. DOI : 10.3760/cma.j.issn.0253-3766.2012.04.013
- Onozawa M, Nihei K, Ishikura S, Minashi K, Yano T, Muto M, et al. Elective nodal irradiation (ENI) in definitive chemoradiotherapy (CRT) for squamous cell carcinoma of the thoracic esophagus. Radiotherapy and Oncology. 2009 Aug;92(2):266–9. DOI : 10.1016/j.radonc.2008.09.025
- Li Q, Zhu S, Li S, Deng W. Elective nodal irradiation provides a superior therapeutic modality for lymph node positivity esophageal squamous cell carcinoma patients receiving definitive radiotherapy versus involved-field irradiation. Medicine. 2019 Jan;98(3):e14080. DOI : 10.1097/MD.0000000000014080
- Ishikawa H, Sakurai H, Tamaki Y, Nonaka T, Yamakawa M, Saito Y, et al. Radiation therapy alone for stage I (UICC T1N0M0) squamous cell carcinoma of the esophagus: Indications for surgery or combined chemoradiotherapy. J Gastroenterol Hepatol. 2006 Aug;21(8):1290–6. DOI : 10.1111/j.1440-1746.2006.04089.x
- Ma J-B, Song Y-P, Yu J-M, Zhou W, Cheng E-C, Zhang X-Q, et al. Feasibility of Involved-Field Conformal Radiotherapy for Cervical and Upper-Thoracic Esophageal Cancer. Onkologie. 2011;34(11):599–604. DOI : 10.1159/000334194
- Ji K, Zhao L, Yang C, Meng M, Wang P. Three-dimensional conformal radiation for esophageal squamous cell carcinoma with involved-field irradiation may deliver considerable doses of incidental nodal irradiation. Radiat Oncol. 2012 Dec;7(1):200. DOI : 10.1186/1748-717X-7-200
- Pengqin X, Jing C, Yanguang Y, X X. Failure modes and clinical targets after radical radiotherapy for esophageal cancer. Discussion on Volume. Journal of Nantong University (Medical Edition). 2012;32(6):539–41.
- Su X-D, Zhang D-K, Zhang X, Lin P, Long H, Rong T-H. Prognostic factors in patients with recurrence after complete resection of esophageal squamous cell carcinoma. Journal of thoracic disease. 2014 Jul;6(7):949–57. DOI : 10.3978/j.issn.2072-1439.2014.07.14